LA RICINA
INTRODUCCIÓN
La ricina es una de las toxinas naturales más potentes y está entre los venenos más peligrosos conocidos. Una cantidad tan pequeña como 500 mg puede matar a una persona adulta En toxicología forense la historia sobre Georgi Markov asesinado por la inyección de ricina mediante un paraguas adaptado como arma, es uno de los casos más conocidos de homicidio debido a la relación del caso con los servicios secretos y el espionaje. Esta toxina está consiguiendo una amplia atención por ser considerado como un posible agente empleado por terroristas.
Origen:
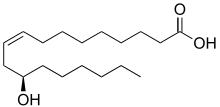
La ricina es una potente fitotoxina con actividad citotóxica que se obtiene de las semillas de la planta de ricino (Ricinus Communis L., familia Euphorbiaceae) y su nombre procede del parecido de sus semillas a la especie de garrapata Ixodes ricinus. Estas semillas contienen un 46-53% de aceite compuesto de glicéridos (producto de esterificación de ácidos grasos con glicerina) de distintos ácidos como los ácidos ricinoleico (Fig. 2) e iso-ricinoleico.
Fig. 1: Ricinus communis.


Fig. 2: El ácido ricinoleico (ácido 12-hidroxi-9-cis-octadecenóico) es un ácido graso omega 9 insaturado.
La ricina purificada es un polvo blanco soluble en agua y estable en un amplio rango de pH.
La semillas de la ricina son generalmente tóxicas si son masticadas o maceradas y se libera el principio activo. Las semilla, raíces y hojas de la planta también se han empleado en remedios tradicionales de algunas poblaciones o tribus en todo el mundo.
ESTRUCTURA Y BIOQUIMICA
Pertenece a las proteínas conocidas como proteínas inactivadoras de ribosomas (RIP en inglés ribosome-inactivating proteins).Su estructura está formada por dos cadenas polipeptídicas, una denominada cadena A con capacidad inhibidora de síntesis de proteínas a nivel de los ribosomas al tener y otra denominada cadena B, (este tipo de proteínas por tener dos cadenas se denomina es de tipo RIP 2). Ambas cadenas se unen mediante un puente disulfuro formando la toxina. La cadena B es catalíticamente inactiva pero sirve para facilitar la entrada en la célula del complejo proteínico A-B. Se ha demostrado que se pueden unir entre 106-108 moléculas de ricina por célula. Una única molécula de ricina puede inactivar del orden de 1500 ribosomas por minuto y matar a la célula. Morfológicamente tiene un aspecto globular con una hendidura muy pronunciada. En esta zona dos residuos del aminoácido tirosina atraparán a una adenina diana de una zona específica de la subunidad 60S ribosomal. La capacidad enzimática de romperá el enlace entre una adenina y una ribosa del ácido ribonucleico inhibiendo así la síntesis de proteínas.
La actuación enzimática de las RIPs tanto de una como de dos cadenas provoca la hidrólisis del enlace N-glucosídico entre la adenina y la ribosa de un nucleósido ( el A-4324 del 28 S de los ribosomas de mamífero). El resultado de esta acción enzimática es que el ribosoma apurínico resultante es inactivo en síntesis de proteínas. Debido a la presencia de la cadena B, que es capaz de fijarse a receptores de membrana plasmática y promover la internalización del complejo toxina-receptor. Posteriormente la ricina es transportada al aparato de Golgi y de allí es transferida al retículo endoplasmático rugoso en donde se disocia permitiendo la entrada en el citosol de la cadena A, que es la especie enzimáticamente activa y allí inactiva a los ribosomas.
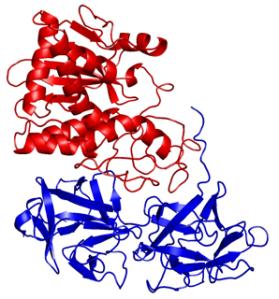
Estructura de la ricina. La cadena A se muestra en azul y la B en naranja
EFECTOS DE LA MOLÉCULA EN EL ORGANISMO. Síntomas de la exposición a Ricina.
La manifestación de los síntomas de exposición a ricina dependen de la ruta de exposición y de la dosis recibida.
Los primeros síntomas por vía inhalatoria se producen dentro de las primeras 8 horas tras la exposición. Si se produce ingestión los síntomas iniciales típicos ocurren en menos de seis horas. La progresión en la sintomatología clínica se produce entre 4-36 horas. La muerte puede producirse entre 36-72 h horas posteriores a la exposición dependiendo de la ruta y dosis. Se han dado casos de personas expuestas y que no han sufrido ningún tipo de toxicidad y, en algunos casos, los síntomas han aparecido mucho más tarde de lo esperado.
Ingestión
La dosis letal en ratones (LD50: dosis letal que mata al 50% de la población a la que se le ha suministrado la misma dosis) es de 30 mg/kg. Esta cantidad es aproximadamente 1000 veces superior a la necesaria por inyección o inhalación. Se considera que en humanos la dosis letal es de 1-20 mg/kg de peso corporal. La ingesta de semillas puede proporcionar una dosis variable de ricina, debido a la diferencia en tamaño y contenido que existir en cada una de ellas. En India, México, Jamaica y en algunos países de África las semillas de ricino se utilizan en la fabricación de collares y en medicina natural como purgante, anticonceptivo, e incluso en el tratamiento de la lepra y de la sífilis. De ahí que sean frecuentes las intoxicaciones por ingesta de semillas. En algunos casos, éstas son previamente tostadas con el fin de inactivar la toxina, ya que el tratamiento a 80ºC durante 10 minutos o a 50ºC durante una hora es capaz de destoxificar la toxina. Son frecuentes los casos de intoxicación en niños, ya que los dibujos y colores de las semillas le dan un aspecto que les resulta atractivo, a pesar de que el fuerte sabor amargo descrito al masticarlas debería provocar su rechazo. Si no son masticadas antes de ser deglutidas, la posibilidad de que se presenten manifestaciones clínicas es menor o, en su caso, los síntomas y signos serán menos graves. Habitualmente, si la ingesta es superior a 1 semilla en niños o superior a 8 en adultos, se suele considerar que hay riesgo de muerte. Las manifestaciones clínicas más frecuentes incluyen vómitos, dolor abdominal y diarrea. Se complica con deshidratación severa, caída de la presión sanguínea y pueden existir alucinaciones, convulsiones y sangre en orina.
Inhalación
Por vía inhalatoria y tras un período de latencia de 4-8 horas, las manifestaciones clínicas incluyen distrés respiratorio (dificultad para respirar) fiebre, dolor en el pecho, tos, disnea, náuseas y artralgia (dolor en articulaciones), sudoración profusa y edema pulmonar. Estudios in vivo en ratas y ratones han dado lugar, tras un período de latencia de 12-24 horas, a letargia y dificultad para respirar. La muerte sobreviene entre 27 y 96 horas después de la exposición. La coloración de la piel puede volverse azul. Finalmente hay una caída en la tensión arterial y fallo respiratorio que conducen a la muerte. Los estudios histopatológicos muestran necrosis difusa del epitelio de vías respiratorias y alvéolos. La LD50 en ratones es de 5 mg/kg.
Vía dérmica
La ricina no se absorbe a través de la pile y su contacto provoca irritación y dolor tanto en piel como en los ojos.
Inyección de la ricina
En cuanto a los efectos por administración vía parenteral, la LD50 en ratones es de 5-10 mg/kg distintos estudios in vivo en distintos animales muestran que, tras administrar ricina marcada con yodo-125 por esta vía, ésta se distribuye especialmente en hígado, bazo y nódulos linfáticos y se excreta en orina, una vez degradada. En los estudios histopatológicos se ven lesiones de tipo necrótico y apoptótico. En el hígado las primeras lesiones celulares se producen 4 horas después de la administración. Los síntomas son fiebre, dolor de cabeza y abdominal, hipotensión y un deterioro generalizado hasta fallo multiorgánico.
Tratamiento
El tratamiento es complicado porque tiene que atender a fallos multiorgánicos. No hay antídoto posible y tratado a tiempo la ingestión es posible revertirla mediante lavados gástricos o con carbono activo. La diálisis no es efectiva. La inhalación exige tratamientos agresivos de oxigeno terapia, broncodilatadores e intubación endotraqueal. En la mayoría de los casos no hay éxito debido al largo período existente entre la intoxicación y el tratamiento médico, lo que conlleva el fallecimiento de la víctima.
Uso terapéutico
Se ha sugerido que las células malignas tumorales son más susceptibles a la toxicidad por ricina al poseer más en la superficie celular más carbohidratos a los que podrá unirse la toxina. De esta forma se han investigado conjugaciones de anticuerpos a los que se ha ligado ricina contra células tumorales.
El establecimiento de las inmunotoxinas como herramientas terapéuticas vino con las denominadas inmunotoxinas de primera generación, consistentes en la cadena A de la ricina procedente de la disociación de ricina en medio reductor unida por puentes disulfuro a un anticuerpo monoclonal dirigido a la célula blanco. Sin embargo, la presencia de pequeñísimas cantidades de cadena B contaminante permitía la reconstitución de la molécula de ricina y confería a las preparaciones de inmunotoxina una toxicidad inespecífica intolerable para una terapia eficaz y segura.
Se produce así una especie de ricina que se denomina ricina bloqueada que presenta mucho menos toxicidad inespecífica que la ricina nativa. Una de estas inmunotoxinas con ricina bloqueada se encuentra ya en el mercado con el nombre de oncolisina y ha demostrado una notable efectividad en ciertos tipos de linfoma.
Un grave problema es la neutralización inmunológica de las inmunotoxinas. Las RIPs, como proteínas que son, desarrollan resistencia inmunológica al ser inyectadas en el organismo, por lo que la eficacia de una inmunotoxina viene dada no solo por su actividad específica sino también por la aparición de anticuerpos neutralizantes en el organismo receptor. En ensayos clínicos con ratones, se ha puesto de manifiesto el problema de la aparición efectiva de anticuerpos neutralizantes tanto frente a la parte tóxica de la inmunotoxina como frente al anticuerpo monoclonal. Una buena solución es la de disponer de una gran variedad de RIPs inmunológicamente distintas y que puedan conjugarse a distintos anticuerpos dirigidos frente al mismo blanco para aumentar así el arsenal de inmunotoxinas.
Otro problema que se ha observado en la terapia con inmunotoxinas es el denominado síndrome de pérdida o derrame vascular. Este problema surge con la administración de inmunotoxinas de ricina y consiste en la destrucción de capilares de manera aparentemente inespecífica, lo cual conlleva extravasación de sangre y formación de edema.
Uso como arma biológica
EE.UU inició un programa de investigación y desarrollo con ricina, a la que denominaron compuesto W, con el fin de sustituir al fosgeno, el agente neumotóxico empleado en la I Guerra Mundial en aquel momento. La principal ventaja consistía en que, por vía inhalatoria, la ricina era 40 veces más tóxica que el fosgeno. Por lo tanto, la cantidad a incorporar a los sistemas de diseminación en aeronaves con el fin de conseguir un determinado efecto en el área de operaciones también sería menor. Existían dificultades en su incorporación en los proyectiles, era un problema que el efecto térmico de la explosión no alterase la toxina y, por otro lado, existía la dificultad de obtener aerosoles con diámetros aerodinámicos de partícula adecuados para su diseminación. También era un agente difícil de controlar en función de las condiciones climáticas, de igual forma que lo era el fosgeno.
La ricina saltó al estrellato de los venenos “modernos” por el asesinato de Georgi Markov en 1978.
El asesinato del periodista búlgaro y defensor de los derechos humanos, exiliado en el Reino Unido, Georgi Markov se suele citar como un caso demostrado de terrorismo de Estado en el que se administró ricina con el ya famoso “paraguas asesino”, un paraguas modificado para disparar una pequeña bola que podía contener hasta 500 μg de la toxina.
El 7 de septiembre de 1978 Markov se encontraba en el puente de Waterloo esperando un autobús para ir a su oficina cuando sintió un pinchazo en la parte posterior del muslo derecho y al girarse un hombre que portaba un paraguas le pidió perdón. Al día siguiente fue ingresado con fiebre, vómitos, dificultad para hablar y el recuento leucocitario era de 10.600/mm3.
El 11 de septiembre el recuento de leucocitos había aumentado a 33.200/mm3. Ese mismo día murió. En la autopsia se encontró en el muslo derecho una bola metálica de 1,53 mm de diámetro, 90% de platino y 10% de iridio con dos agujeros de 0,34 mm de diámetro, con una capacidad de contener 0.28 mm3 de tóxico, de la cual no se pudo aislar tóxico. Se supone que estaba recubierta por azúcares diseñados para fundirse a 37ºC. Tampoco se pudo encontrar el paraguas asesino, con lo cual son hipótesis los mecanismos descritos para la inyección. La autopsia mostró hemorragia intestinal, edema pulmonar, hígado graso y necrosis en nódulos linfáticos.
Días antes de este incidente, el 26 de agosto, otro exiliado búlgaro residente en París, Vladimir Kostov, se encontraba en el metro y sintió un pinchazo en la espalda. Estuvo ingresado durante 12 días y el único signo observado fue fiebre.
Por las coincidencias con el caso Markov una brigada antiterrorista del Reino Unido se trasladó a París y el 26 de septiembre se extrajo de su espalda una bola de 1,52 mm de diámetro con dos agujeros de 0,34 mm de diámetro, es decir, prácticamente idéntica a la de Markov.
La realidad es que nunca se llegó a detectar ricina en las muestras de tejidos y fluidos biológicos de Markov y Kostov. La posibilidad de que fuese ricina fue indicada por los científicos del establecimiento de defensa química y biológica del Reino Unido en Porton Down, basándose en las observaciones histopatológicas, parecidas a las descritas en estudios in vivo en distintos modelos animales, y en los informes de los servicios de inteligencia sobre la existencia de programas militares con ricina en países del antiguo Pacto de Varsovia.
Los investigadores de Porton Down incluso llegaron a administrar ricina a un cerdo, con el fin de comparar las manifestaciones clínicas con las de Markov. Tras un período de latencia de 6 horas se observó hipertermia y leucocitosis, produciéndose la muerte a las 24 horas.
Desde aquellos años numerosos gobiernos y grupos terroristas han intentado emplear ricina con fines criminales con escaso éxito. Desde Irak, grupos islamistas como Al Qaeda han intentado su empleo en países como Inglaterra, España o EEUU. Las ventajas que presentaría la intoxicación por ricina, utilizada como arma, incluirían un período de latencia de varias horas; la poca especificidad de los síntomas y signos por cualquier vía de exposición y la inexistencia de un antídoto.
Por otro lado, chiflados con afán de notoriedad han enviado cartas a la Casa Blanca y el Capitolio. Las últimas fueron enviadas al presidente Barack Obama, al alcalde de Nueva York, Michael Bloomberg y al director de la fundación Contra Armas Ilegales el 30 de mayo de 2013. La autora, una actriz tejana llamada Shannon Rogers se enfrentaría a una condena de 15 años de cárcel. Los sobres con ricina fueron franqueados el 20 de mayo, las cartas eran anónimas y las tres contenían el mismo mensaje amenazador: «Tendrás que matar a mi familia y a mí antes de llevarte nuestras armas. Cualquiera que entre en mi casa recibirá un tiro en la cara. El derecho a tenerlas es constitucional, un derecho otorgado por dios y que ejerceré hasta el día que me muera. Lo que expresa esta carta no es nada en comparación con lo que tengo planeado hacerte a ti». La cantidad de ricina era mínima y no fue un riesgo para la salud de los receptores. El único que sufrió alguna consecuencia fue el director de la fundación Contra Armas Ilegales, porque hubo contacto directo del veneno en los ojos.
Este artículo se escribió con Natalia Moñivas Lázaro y Nieves Repollés García, alumnas de Técnico Superior de Laboratorio de Diagnóstico Clínico del CFP Puerta de Hierro Majadahonda.
BIBLIOGRAFÍA
– Tomás Girbés, Juan. Proteínas Inactivadoras de Ribosomas (RIPs) y sus Aplicaciones en la Construcción de Inmunotoxinas para la Terapia Experimental del Cáncer. Anal. Real Acad. Farm. 2000, 66.
– Musshoff, Frank y Madea Burkhard. Ricin poisoning and forensic toxicology. Drug Tes Analysis 2009; 1: 184-191.
– Pita R, Anadón A y Martínez-Larrañaga MR. Ricina: una fitotoxina de uso potencial como arma. Rev. Toxicol. (2004) 21: 51-63.
– Mendel Friedman, Reuven Rasooly. Review of the Inhibition of Biological Activities of Food-Related Selected Toxins by Natural Compounds.Toxins 2013, 5, 743-775; doi:10.3390/toxins5040743
– http://www.analesranf.com/index.php/aranf/article/viewFile/50/88
– http://www.iqb.es/monografia/toxinas/ricina.htm
– http://www.redalyc.org/pdf/919/91921301.pdf
–
















